Kaye Validator® AVS为高压灭菌器提供温度验证——确保温度验证合规性
来源:Amphenol(安费诺)
发布时间:2025-09-26
一. 背景简介|为什么温度验证是硬指标?
在制药、生物技术及医疗器械等行业中,灭菌是确保产品无菌性和避免微生物污染的关键工艺,而温度验证正是对灭菌过程“是否可靠”的明确回答。
特别是在使用高压蒸汽灭菌器(Autoclave)的场景中,必须验证设备在整个灭菌周期内所有区域都能达到设定温度(通常为121°C或更高)。这样才能确保所有微生物被致死,从而保障产品无菌性、设备合规性和批次一致性。
无验证的灭菌系统将存在冷点、热不均等问题,极易导致灭菌失效,影响企业质量体系,甚至可能引发产品召回和合规处罚。
二. 适应全球法规标准|法规标准,全面合规
Kaye Validator® AVS 系统符合国际及中国监管机构的主要法规标准,尤其适用于对数据完整性、过程控制和验证记录有严格要求的场景。
相关国际法规标准要求包括:
21 CFR Part 11(美国FDA)–电子记录和签名的完整性规范,重点在于数据防篡改、访问控制和审计追踪。
GMP(良好生产规范) – 21 CFR Parts 210 & 211
FDA行业指南 – 通过无菌工艺生产无菌药物产品
ISO EN 285:大型蒸汽灭菌器热分布测试与验证标准
ISO EN 17665:湿热灭菌方法的验证规范
ISO EN 11138:灭菌过程中的生物指示剂应用指南
HTM 2010(英国国家健康服务体系):医院高压灭菌器设计与运行指南
相关中国法规包括:
《药品生产质量管理规范(GMP)》(2010年修订)及附录《无菌药品》:明确系统应定期进行热分布验证,记录生成需电子化、可追溯。
《药品生产监督管理办法》(2022年施行):明确规定必须对灭菌设备进行验证,并记录验证全过程。

Kaye AVS系统通过其软件安全机制、传感器安装规范及数据追溯方案,完全满足中美欧多地法规要求,为全球制药企业打造统一、合规的验证标准平台。
三. 技术优势概览|精准、合规、自动化
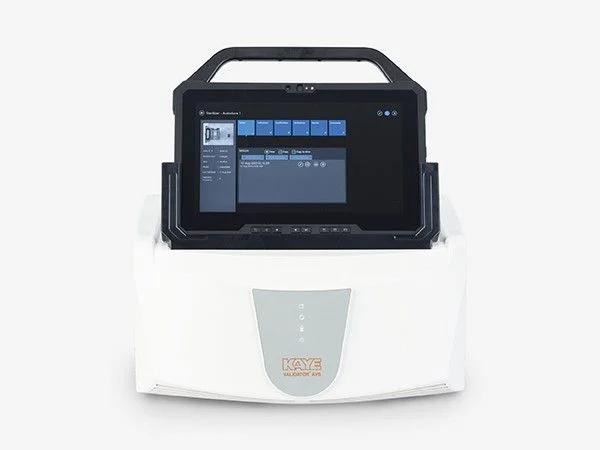
Kaye Validator AVS 以高性能测量硬件为核心,配合智能化软件支持,为用户构建精准、稳定、可追溯的验证流程,确保灭菌和环境系统始终在预设参数范围内运行,从而消除污染风险和合规漏洞。
1.主要功能
验证热分布:确保在空载、部分负载和满载条件下,所有区域的温度均匀且一致。
识别冷点:检测无法达到灭菌温度的区域,这对验证灭菌完整性至关重要。
传感器校准:确保在整个腔体内精确记录温度。
验证文档:用于审计和符合监管要求。
2.技术参数
热电偶:T、J、K、E、B、R、N、S型,精度为 0.1°C;T分度分辨率为 0.01°C
模拟输入:支持多达 48 个通道
扫描速率:每秒多达 48 个通道
内部存储:32 GB 用于数据记录
电压输入:0 至 10 VDC;分辨率为 1:72,000
电池备份:锂电池,最少支持3小时
3.校准与服务支持
可实现传感器的自动校准与修偏
在中国常州设有CNAS认证校准实验室,可提供本地化服务
配套附件完整,以简化您的验证工作

四. 广泛应用领域|真正覆盖生命科学环境
Kaye Validator AVS 适用范围广,不仅限于高压蒸汽灭菌器,还涵盖多种洁净环境和处理设备:
蒸汽灭菌器(高压灭菌器)
干热灭菌器
在线灭菌(SIP)
水浴灭菌柜
培养箱
稳定性试验箱
冰箱
冻干机/冻干工艺
罐等容器
AVS适用于任何需要精确监测和记录温度、压力或湿度并确保可追溯性的应用场景。系统符合21 CFR Part 11标准,提供完整的数据完整性、审计跟踪及安全数据处理功能。
五. 配套验证文档与审计准备
AVS系统提供完整、可追溯的记录,为审计做准备。同时,在产品放行前识别不一致或故障,以降低风险。
通过部署Kaye AVS,企业不仅能实现数字化验证转型,还能大幅减少人工录入和文件整理时间,有效提升审计应对能力。
六. 结语|可靠验证,全球合规
Kaye Validator® AVS 是一款兼顾“全球法规+本地实用性”的高端验证-系统,广泛应用于疫苗、抗体、生物制剂、无菌注射剂、原料药等生产车间。
Kaye作为安费诺集团旗下全球温度验证技术领导者,高度重视中国市场需求。除验证系统外,还提供温度标准、校准装置等全系列设备及系统培训服务,支持整套验证流程。
Kaye在国内拥有唯一的销售和校准服务中心——江苏常州CNAS校准实验室,可以方便快捷地为国内客户验证保驾护航!
免责声明
- 1、本文内容版权归属原作者、原发表出处。若版权所有方对本文的引用持有异议,请联系感算商城(service@gansuan.com),我方将及时处理。
- 2、本文的引用仅供读者交流学习使用,不涉及商业目的。
- 3、本文内容仅代表作者观点,感算商城不对内容的准确性、可靠性或完整性提供明示或暗示的保证。读者阅读本文后做出的决定或行为,是基于自主意愿和独立判断做出的,请读者明确相关结果。
- 4、如需转载本方拥有版权的文章,请联系感算商城(service@gansuan.com)注明“转载原因”。未经允许私自转载感算商城将保留追究其法律责任的权利。







